無菌檢查方法學 驗證介紹
無菌檢查方法是為了檢查藥典要求無菌的制劑及其他制品是否無菌而建立的試驗方法,是作為無菌產品批放行的重要依據及藥監部門對無菌產品質量監管的一個重要項目。因此如何確保無菌檢查方法的準確可靠至關重要,而檢查方法的驗證是保證檢查結果的公正、科學和準確的基礎,中科檢測開展無菌檢查及無菌檢查方法學驗證服務,可為藥企開展注冊檢驗提供檢測報告。
無菌檢查方法學 驗證類型
無菌檢查方法驗證一般分為前驗證和再驗證兩種。
前驗證,也稱預驗證,指在無菌檢查分析方法正式使用前,按照預定驗證方案進行的驗證。如果沒有充分的理由,任何檢查方法必須進行前驗證。
再驗證,指某一檢查方法經過驗證并在使用一段時間后進行的,旨在證實已驗證狀態沒有發生飄移而進行的重新驗證及對檢查方法進行修訂、改變時進行的驗證。
無菌檢查方法學 驗證菌種
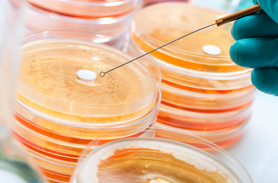
無菌檢查方法驗證中通常選擇以下6種試驗中常用的控制菌的標準菌株,它們分別代表不同類型的菌種:枯草芽孢桿菌 [CMCC(B)63 501]代表藥品中常見的污染菌——芽孢桿菌、金黃色葡萄球菌 [CMCC(B)26 003]代表革蘭陽性菌、生孢梭菌 [CMCC(B)64 941]代表厭氧菌、大腸埃希菌 [CMCC(B)44 102]代表革蘭陰性菌、白色念珠菌 [CMCC(F)98 001]代表酵母菌、黑曲霉菌 [CMCC(F)98 003]代表霉菌。
無菌檢查方法學 驗證方法
無菌檢查方法學驗證試驗設計
薄膜過濾法:按照藥典的要求取每種培養基規定接種的樣品總量按薄膜過濾法過濾、沖洗,在最后一次的沖洗液中加入小于100cfu的試驗菌,過濾。取出濾膜接種至硫乙醇酸鹽流體培養或改良馬丁培養基中,或將培養基加至濾桶內。另取一裝有同體積培養基的容器,加入等量試驗菌,作為對照。按照藥典的要求的溫度和時間進行培養。
直接接種法:取符合直接接種法培養基用量要求的硫乙醇酸鹽流體培養基8管,分別接入小于100cfu的金黃色葡萄球菌、大腸埃希菌、枯草芽孢桿菌、生孢梭菌各2管;取符合直接接種法培養基用量要求的改良馬丁培養基4管,分別接入小于100?cfu的白色念珠菌、黑曲霉各2管。其中1管接入每支培養基規定的供試品接種量,另1管作為對照,按照藥典的要求的溫度和時間進行培養。


 電話:400-133-6008
電話:400-133-6008 地址:廣州市天河區興科路368號(天河實驗室)
地址:廣州市天河區興科路368號(天河實驗室)
廣州市黃埔區科學城蓮花硯路8號(黃埔實驗室) 郵箱:atc@gic.ac.cn
郵箱:atc@gic.ac.cn





























 立即咨詢
立即咨詢 留言咨詢
留言咨詢